問題
次の文(A)~(C)を読んで, 問1~問6に答えよ。解答はそれぞれ所定の解答欄に記入せよ。
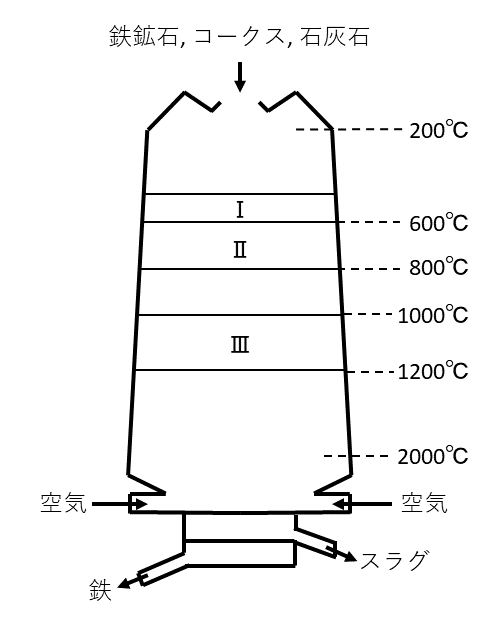
(A) 図1は鉄の精錬に用いられる溶鉱炉の模式図である。溶鉱炉は上部から下部に向かって温度が高くなる構造になっており, 図中のⅠ~Ⅲの3つの温度域で起こる反応によって原料の鉄鉱石(酸化鉄)から金属鉄が生成する。\( \require{mhchem} \ce{Fe2O3} \)を主成分とする赤鉄鉱などの鉄鉱石をコークス(炭素)と石灰石とともに上部から炉に入れる。炉の下部から熱い空気を送り込むとコークスが燃焼し\( 2000 {}^{\circ}\rm{C} \)の高温に加熱され, アが発生する。炉の上部から供給された\( \ce{Fe2O3} \)は下から上昇してくる熱いアと接触し, 温度域Ⅰで,
①
の反応によりイに還元される。次にイは温度域Ⅱでさらに還元されウになる。鉄への最終的な還元は温度域Ⅲで進行する。Ⅰ~Ⅲの温度域でアは酸化されエになる。鉄の生成過程全体を通して, 十分なアの供給を確保しているのは,
②
の反応である。石灰石は\( 900 {}^{\circ}\rm{C} \)ぐらいのところで分解して, 生石灰になり, 炉のもっとも熱い部分で鉄鉱石に含まれる\( \ce{SiO2} \)などをカルシウムの化合物にして, 鉄と分離する働きをしている。分離した鉄は最も高密度の層を形成して炉の底にたまる。これを引き出し, 凝固させた鉄は炭素含有量が高く, 硫黄, リンなどを含みaと呼ばれる。
(B) 金属鉄(\( \ce{Fe} \))はオを発生しながら希硫酸に溶けて, b価のイオンを含む水溶液ができる。この水溶液を2つの試験官に分け, 一方にヘキサシアノ鉄(Ⅲ)カリウムカの水溶液を加えると③の沈殿が生じる。また, もう一方の試験官の水溶液に過酸化水素水を加えると\( \ce{Fe} \)はc価にdされ, 水溶液の色は④から⑤になる。この水溶液にチオシアン酸カリウム水溶液を加えると⑥になる。
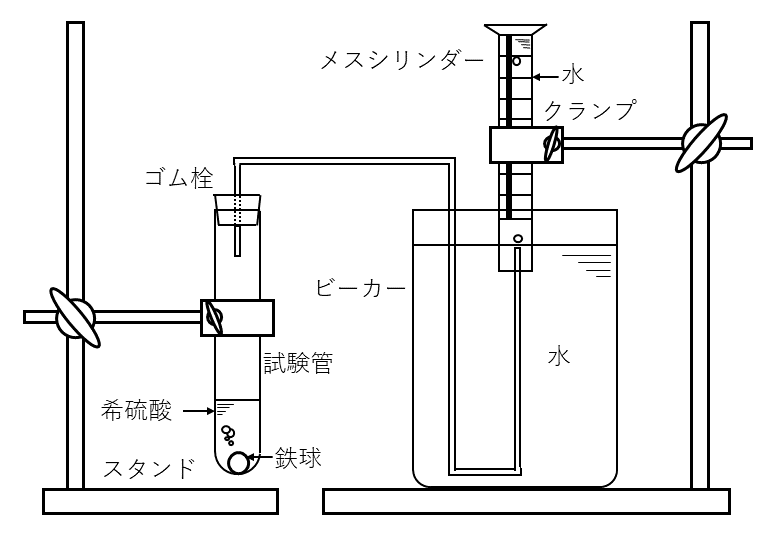
(C) 上記(B)の下線部に関して, A君は鉄球を希硫酸に入れたときのガスの発生速度は鉄球の重量に依存するという仮説を立てて次のような実験を行うこととした。図2のような装置を用い, 鉄球を入れて試験官にゴム栓をしてからの時間を横軸に, メスシリンダーに捕集したガス量を縦軸にとり, 実験初期のグラフの直線部分の傾きよりガスの発生速度を求めることとした。なお, この実験中の温度や気圧は一定に保たれ, また水温や試験管中の溶液の温度は一定に保たれるように工夫がなされている。
問1 文中のア~カに適切な化学式を記入せよ。なお, カにはヘキサシアノ鉄(Ⅲ)カリウムの化学式を記入すること。
問2 文中のa, dに適切な語句を, またb, cに適切な数字を記入せよ。
問3 文中の①, ②に適切な反応式を記入せよ。
問4 文中の③~⑥に以下から適切な色を1つずつ選び, 記入せよ。
黄かっ色, 赤色, 暗紫色, 淡緑色, 深緑色, 白色, 濃青色, 無色
問5 A君は実験を始める前に先生に相談したところ, 図2のようにメスシリンダーを固定した状態で測定されたガス体積をそのまま, 時間に対してプロットしたのでは, ガスの発生速度は正確には測れないといわれた。同じ器具を用いてガスの発生速度を正確に測るにはどのようにすればよいかを30字程度で記入せよ。
問6 A君は上記(C)で記された仮説を検証するために, 図2のような装置を組み立て, 重量2g程度の同じ大きさの鉄球1個, 2個, 3個を試験管に入れ, 希硫酸に完全に浸し, それぞれの場合でのガスの発生速度を測定することとした。しかしながら, 先生から, ガスの発生速度が入れた鉄球の個数に比例することを確認したとしても, この実験だけでは, ガスの発生速度が鉄球の重量に比例すると結論できないと指摘された。その理由を1つだけ30字程度で記述せよ。
解説
問1~問4
(A)
アは, コークスを\( 2000 {}^{\circ}\rm{C} \)に加熱すると発生し, 酸化されてエになるので, アは\( \ce{CO} \), エは\( \ce{CO2} \)である。
②の反応式は, \( \ce{C -> CO} \)まで分かっているので, すぐに書ける。
次に, \( \ce{Fe2O3} \)の変化を問題文よりまとめると, 以下のようになる。

鉄の酸化物は, \( \ce{Fe2O3} \), \( \ce{Fe3O4} \), \( \ce{FeO} \)があるので, イ, ウは, \( \ce{Fe3O4} \), \( \ce{FeO} \)のどちらかである。順に還元される(つまり, 酸化数が減る)ので, 酸化数の大きい方がイである。
①の反応式は, 問題文より, \( \ce{Fe2O3 + CO -> Fe3O4} \)までは書けるので, \( \ce{C} \)の辻褄合わせを考えれば書けるはずである。丁寧にやるなら, 酸化還元反応なので, 以下の半反応式を考えてから作成すればよい。
$$\left\{
\begin{array}{l}
\ce{3Fe2O3 + 4H+ + 4e- -> Fe3O4 + 2H2O} \\
\ce{CO + 2H2O -> CO2 + 4H+ + 4e-}
\end{array}
\right.$$
最後に, aについて。鉄の精錬では, 「原料(鉄鉱石)→銑鉄→鋼」の順番を押さえておく。もちろん右に行くほど「良い」性質をもっている。ここでは, 炭素含有量が依然として高い, いわば「中途半端な」方を聞かれているので, 答えは銑鉄である。
(B)
オは, 鉄+酸で発生する酸素。このとき, 鉄は何価のイオンになるかは知らないので, 後ろの問題文を見て考える。ヘキサシアノ鉄(Ⅲ)と反応するのは, 鉄(Ⅱ)イオンの方だから, bは2。
鉄イオン系の色をまとめると以下の通り。全て重要。
| \( \ce{Fe2+} \) | \( \ce{Fe3+} \) | |
|---|---|---|
| 色 | 淡緑色 | 黄褐色 |
| 水酸化物の色 | 緑白色 | 赤褐色 |
| ヘキサシアノ鉄(Ⅱ)カリウムを加える (\( \ce{K4[Fe(CN)6]} \)) | 濃青色 | |
| ヘキサシアノ鉄(Ⅲ)カリウムを加える (\( \ce{K3[Fe(CN)6]} \)) | 濃青色 | |
| チオシアン酸カリウムを加える (\( \ce{KSCN} \)) | 血赤色 |
後半, 「\( \ce{Fe} \)はc価にdされ, …」の部分も, 鉄(Ⅱ)イオンからは一応酸化と還元の2通り考えられるので, 後ろの文から考える。チオシアン酸カリウムが出てきた時点で, \( \ce{Fe3+} \)と確定する。
問5
気体の状態量(\( P, V, T \))には, 常に注意しなければならない。気体の体積と一言で言っても, 圧力や温度によって変化する。よって, 圧力や温度を一定にして, 体積を測定する必要がある。
温度や気圧(大気圧)は一定と書いてあるので, 気体の分圧が変化する可能性があると思われる。メスシリンダーを固定した状態ではダメだと書いてあるので, 固定を外してどうするかを考えると, シリンダー内の水面を常に外の水面と一致させるように動かすことで, 気体の分圧が一定になりそうである。
問6
この実験のおかしいところは, すぐにわかったのではないだろうか。もちろん, 気体の発生量は, 鉄の重量ではなく, 表面積に比例すると考えられる(固体の反応物を粉々にして, 反応速度を上げる方法をよく知っているはずである)。
振り返り
問5以外は完答すべき問題。鉄は京大では出題頻度が高いので, 教科書レベルの知識は完璧に押さえておく必要がある。
コメント