問題
A 次の文を読んで, 問に答えよ。
ハロゲン化ナトリウム(\( \require{mhchem} \ce{NaX} \))の結晶は, イオン結晶で, すべて\( \ce{NaCl} \)型の結晶構造をもつ。この構造では, 1個の\( \ce{Na+} \)に最も近い\( \ce{X-} \)の数は( a )個であり, 1個の\( \ce{Na+} \)に最も近い\( \ce{Na+} \)の数は( b )個である。いま, \( \ce{Na+} \)と\( \ce{X-} \)とを, それぞれ4個ずつ含む立方体を単位格子とし, その一辺の長さ\( a \)を格子定数とする。この単位格子の体対角線注)に垂直な, イオンを含む面を考えると, 面間隔(ア){①\( \frac{1}{4} \) ②\( \frac{1}{5} \) ③\( \frac{1}{6} \) ④\( \frac{1}{7} \)}\( \times \sqrt{3}a \)で, (イ){①\( \ce{Na+} \)と\( \ce{X-} \)とを同数個含む面が ②\( \ce{Na+} \)のみを含む面と\( \ce{X-} \)のみを含む面とが交互に}ならんでいることがわかる。\( \ce{NaF} \)と\( \ce{NaI} \)の格子定数を, それぞれ\( 4.62 \)Å, \( 6.46 \)Åとすると, \( \ce{Na+} \)と\( \ce{X-} \)との最短距離は, \( \ce{NaF} \)の結晶では( c )Åとなり, \( \ce{NaI} \)の結晶では( d )Åとなる。\( \ce{Na+} \)と\( \ce{X-} \)とは静電気的な引力によって結合しているので, その結合力は両イオン間の距離の( e )乗に反比例する。したがって, \( \ce{Na+} \)と\( \ce{F-} \)との間の結合力は, \( \ce{Na+} \)と\( \ce{I-} \)との間の結合力の約(ウ){①\( 0.5 \) ②\( 0.7 \) ③\( 1.4 \) ④\( 2.0 \)}倍となり, \( \ce{NaF} \)の方が\( \ce{NaI} \)よりも融点が(エ){①高い ②低い}と考えられる。
注) ここでは, 立方体の中心を通り2頂点を結ぶ直線を体対角線と言う。
問 文中の( a )~( e )に適した数値を記入せよ。また, 文中の(ア){ }~(エ){ }について, 最も適したものを選び, その番号を記入せよ。
B 次の(1)~(4)の文は, それぞれ, ある元素\( \ce{M} \)の酸化物\( \ce{M}_x\ce{O}_y \)(\( x, y \)は整数)についての記述である。これらを読んで, 問1~問4に答えよ。ただし, \( \ce{M} \)は次の元素のうちのいずれかである。
$$ \ce{Li, C, N, Na, Al, Si, P, S, Cr, Mn, Fe, Co, Zn, Ba} $$
(1) 黒色光沢をもつ結晶で, 磁気をおびた鉱物として, 天然に存在する。また, この酸化物における\( \ce{M} \)の酸化数の平均値は\( +\frac{8}{3} \)であり, \( \ce{M} \)a+と\( \ce{M} \)b+とが\( 1:2 \)の割合で存在する。この酸化物は, 空気中で加熱すると, 赤色をおびた別の酸化物cに変化する。
(2) \( \ce{M} \)を空気中で燃焼させて得られる白色の粉末で, 白色顔料や医薬品として使われる。この酸化物は, 希酸にも濃アルカリにも溶解する。
(3) この固体は, ( ア )であり, 蒸気圧が高いので, 室温に置くと容易に( イ )する。そのときに要する熱量が大きいので, この固体は冷却剤として用いられる。
(4) 純粋な結晶は無色で, 約\( 1700 {}^\circ \rm{C} \)の融点を示し, 三次元網目構造をもつ( ウ )である。溶融状態から急冷すると容易に( エ )になる。この酸化物は, フッ化水素酸以外の酸には溶解しない。
問1 (1)~(4)の文に最も適した元素\( \ce{M} \)を選び, その酸化物の組成式を, それぞれの解答欄に記入せよ。
問2 (1)の文中のaおよびbに適した数値を記入せよ。また, cに適した酸化物の組成式を記入せよ。
問3 文中の( ア )~( エ )に最も適した語句を, 次の⑴~⑽から選び, その番号を記入せよ。
| ⑴ 融解 | ⑵ 昇華 | ⑶ 分解 | ⑷ 凝固 |
| ⑸ 無定形固体 | ⑹ ゲル | ⑺ 金属結晶 | ⑻ 分子結晶 |
| ⑼ イオン結晶 | ⑽ 共有結合結晶 |
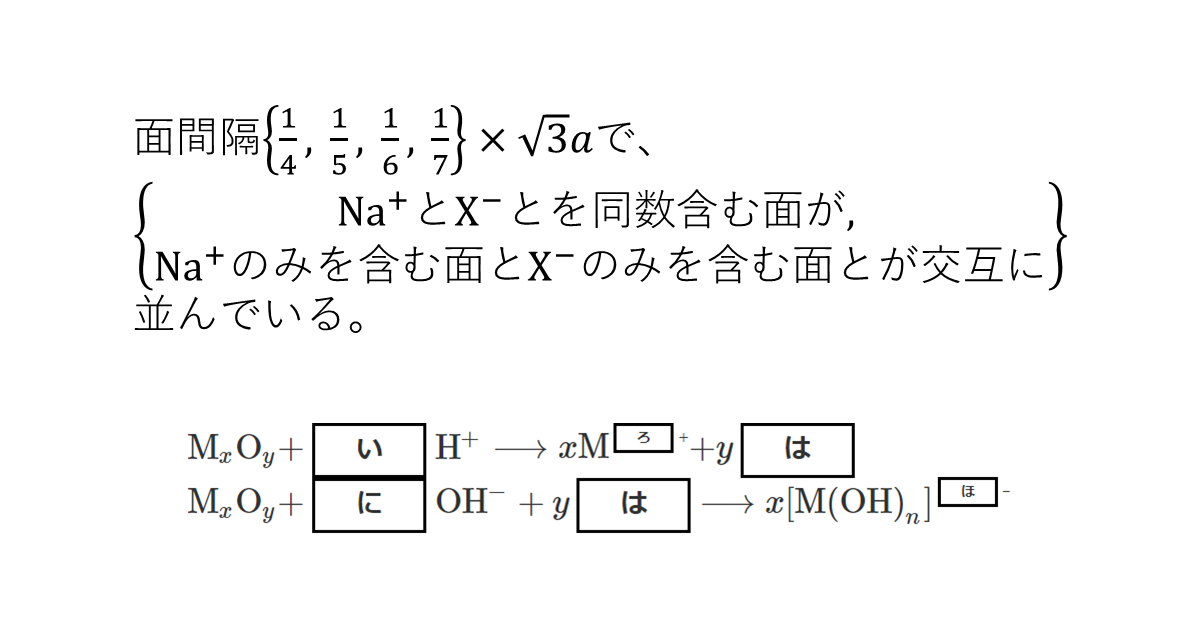
問4 ある両性酸化物\( \ce{M}_x\ce{O}_y \)が, 酸またはアルカリに溶解する反応式を次に示す。い~ほに適した数式または化学式を記入せよ。
\( \ce{M}_x\ce{O}_y + \)い\( \ce{H+ ->} x\ce{M} \)ろ+\( + y \)は
\( \ce{M}_x\ce{O}_y + \)に\( \ce{OH- +} y \)は\( \ce{->} x[\ce{M(OH)}_n] \)ほ–
解説
A
a, b
\( \ce{NaCl} \)が面心立方格子型(2つの面心立方格子をずらして重ねたもの)だという事実は, 頑張って覚えるようなことではない。
イオン結晶の構造として, 主に\( \ce{NaCl} \)型と\( \ce{CsCl} \)型の2種類あり, 基本は\( \ce{NaCl} \)型だと理解しておけばよい。
※塩化セシウムより有名な物質があればそこから名前をとるだろうから, わざわざ塩化セシウム型と名付けるということは, より有名な物質はこの型ではない。また, この2種類以外の構造ももちろんあるが, 出題される場合は問題文を読んだら理解できるように作問されるので覚えなくてよい。
なお, 文中の「\( \ce{Na+} \)と\( \ce{X-} \)とを, それぞれ4個ずつ含む立方体を単位格子」という文言からも, 面心立方格子型だと判断できる。
配位数や個数など, 位置関係だけを知りたい場合は, 以下の図のようにイオン(原子)を質点として図示するとわかりやすい。一方, イオン(原子)の半径が必要な場合は, まず以下の図を書いてから, 特定の平面で切り取り, イオン(原子)同士が接するように書き直す(今回は不要なので書いていない)。
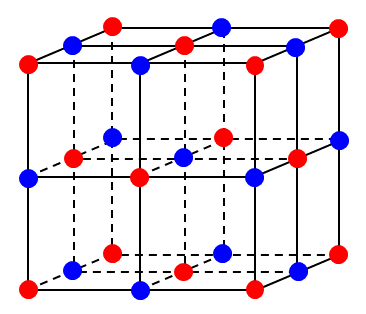
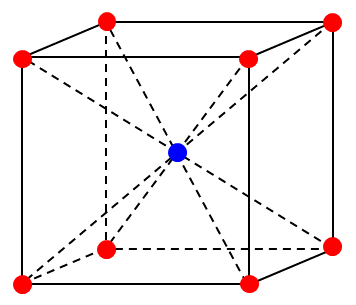
ア, イ
難問なので解けなくても問題ない。上の図を丁寧に書く時間がある人は, 図をよく見ると, 体対角線を6等分して、同じ色の平面が交互に並んでいることがわかるかもしれない。わかりにくい人は, 以下の図を回して見やすい角度から眺めてみるとよい。
c, d
省略。
e, ウ, エ
クーロン力は, \( k\frac{q_1q_2}{r^2} \)より, 距離の2乗に反比例する。このような法則を, 一般に逆二乗の法則と言い, 自然界で広くみられる性質である。
\( q_1 \)や\( q_2 \)は, 化学では電荷数である。ここでは\( \ce{Na+} \)も\( \ce{F-} \)も\( \ce{I-} \)も1価なので, 比例定数に繰り込むことができ, 純粋に距離の2乗だけを計算すればよい(例:2価同士のイオン間のクーロン力は, 4倍になる)。
結合力が強い方が融点が高いのは当たり前。
B
(1)
「酸化数が\( +\frac{8}{3} \)」という情報から\( \ce{Fe3O4} \)で確定。\( \ce{Fe3O4} = \ce{FeO} \cdot \ce{Fe2O3} \)と考えると, \( \ce{Fe^2+} \)と\( \ce{Fe^3+} \)の存在比がわかる。
鉄の酸化物は, 以下の漸次変化を押さえておく。cは\( \ce{Fe2O3} \)と\( \ce{FeO} \)で迷うかもしれないが, 赤矢印の変化を見ると明らかに, 加熱すると右に進むので, \( \ce{Fe2O3} \)が答え。
$$ \ce{Fe} \color{red}{\ce{->}} \ce{FeO -> Fe3O4 -> Fe2O3} $$
なお, \( \ce{Fe2O3} \)は赤褐色(さびの色), \( \ce{Fe3O4} \)と\( \ce{FeO} \)は黒色, ということを知っていれば, 楽に判断できるが, これら鉄の酸化物の色は必須知識とまでは言えない。
(2)
「希酸にも濃アルカリにも溶解する」より両性酸化物であるから, 選択肢の中では\( \ce{Al} \)か\( \ce{Zn} \)のみに絞られる。「白色」の「顔料」から\( \ce{ZnO} \)だと確定。
なお, \( \ce{Al2O3} \)も白色である(「金属酸化物は原則黒系」の例外)。しかし, 高校範囲で「白色顔料」と言えば\( \ce{ZnO} \)がほぼ1対1で対応する。
(3)
選択肢を見ながら考える。最悪与えられた\( \ce{M} \)の酸化物をすべて具体的に書いてみればよい。「冷却剤」がドライアイス(\( \ce{CO2} \))だと気づけばOK。
(4)
「高融点の三次元網目構造」より, 共有結合結晶である\( \ce{SiO2} \)で確定。急速冷凍すると, 巨大な分子が規則正しく配列する前に凝固してしまうので, 無定形固体(=非晶質=アモルファス)となる。
なお, 選択肢中のゲルについて, 二酸化ケイ素からシリカゲルの経路は以下の通り(シリカゲルも無定形固体である)。
・二酸化ケイ素+水酸化ナトリウム→ケイ酸ナトリウム(\( \ce{Na2SiO3} \))
・ケイ酸ナトリウム+水→水ガラス
・水ガラス+塩酸→ケイ酸(\( \ce{H2SiO3} \))
・ケイ酸+乾燥→シリカゲル
また, 文中にあるフッ化水素酸との反応は以下の通り。知らないと書けないので, 暗記をおすすめする。
$$ \ce{SiO2 + 6HF -> H2SiF6(ヘキサフルオロケイ酸) + 2H2O} $$
問4
京大らしい抽象的な問題に見えるが, 両性酸化物の錯イオンによる溶解の反応式を書けるのは\( \ce{Zn} \)と\( \ce{Al} \)のみ(\( \ce{Sn} \)や\( \ce{Pb} \)は書けない)なので, まずは具体的な反応式を書くことから始める。
・\( \ce{Zn} \):\( \ce{ZnO + 2H+ -> Zn^2+ + H2O} \)
・\( \ce{Al} \):\( \ce{Al2O3 + 6H+ -> 2Al^3+ + 3H2O} \)
よって, まずははが\( \ce{H2O} \)だとわかる。あとは, 両辺の電荷と原子数のつり合いの式を立てればよい。
・\( \ce{Zn} \):\( \ce{ZnO + 2OH- + H2O -> [Zn(OH)4]^2-} \)
・\( \ce{Al} \):\( \ce{Al2O3 + 2OH- + 3H2O -> 2[Al(OH)4]-} \)
はが\( \ce{H2O} \)だと判明しているので, これらの具体的な式を書かなくても, 酸の場合と同様に電荷と原子数のつり合いの式を立てれば答えは求まる。しかし, 塩基との反応の式は重要であるため, 確認の意味も込めて記載しておく。そらで書けるようにしておくこと。
振り返り
Aの(ア)(イ)とBの(エ)は出来なくても仕方がない。ただ, Aの(ア)(イ)は, 2008年度に類題が出題されており, 京大はこのように立体的に物事を見る力を重視しているので, 余裕があれば理解しておきたい。
しかし, 合否を分けるのはそこではない。上記以外は全て基礎的な内容であり, それらを間違えなければ十分である。特に問4は, 意外と計算が必要であり, 両性酸化物の反応式という基本に加え, 一般化(抽象化)に慣れていないといけないので, 差が付きやすい。
コメント