問題
次の文(A), (B)を読んで, 問1~問5に答えよ。解答はそれぞれ所定の解答欄に記入せよ。必要があれば, \( \log_{10}2 = 0.301 \), \( \log_{10}3 = 0.477 \), \( \log_{10}7 = 0.845 \)の値を用いよ。また, 水のイオン積は\( 1.0 \times 10^{-14}(\require{mhchem} \ce{mol} / l)^2 \)とする。
(A) 大気汚染の影響のまったくない場合でも, 雨滴は大気中に含まれる二酸化炭素を吸収して\( \ce{H2CO3} \)を生じ, その影響で酸性となる。このため, 酸性雨とは酸性の雨すべてではなく, \( \ce{pH} \)がある値以下の雨をさす。大気汚染の影響のない場合の雨滴の\( \ce{pH} \)は以下のようにして計算できる。
大気中にある二酸化炭素は, 雨滴中に溶け込むと\( \ce{H2CO3} \)となり, その一部は\( \ce{HCO3-} \)や\( \ce{CO3^2-} \)に電離する。温度一定の平衡状態では, 雨滴中の\( \ce{H2CO3} \)濃度\( C (\ce{mol} / l) \)と大気中の二酸化炭素分圧\( P(\ce{atm}) \)との比\( \frac{C}{P} \)は一定となる。比\( \frac{C}{P} \)が\( 3.0 \times 10^{-2} (\ce{mol} / (l \cdot \ce{atm})) \)で, \( 1 \ce{atm} \)の大気中に二酸化炭素が\( 0.032 \% \)(モル百分率)含まれる場合, 平衡状態時には雨滴中にア\( \ce{mol} / l \)の\( \ce{H2CO3} \)が存在する。
雨滴中に溶けた\( \ce{H2CO3} \)の一部は以下の式に従って, \( \ce{H+} \)イオンと\( \ce{HCO3-} \)イオンとに電離する。
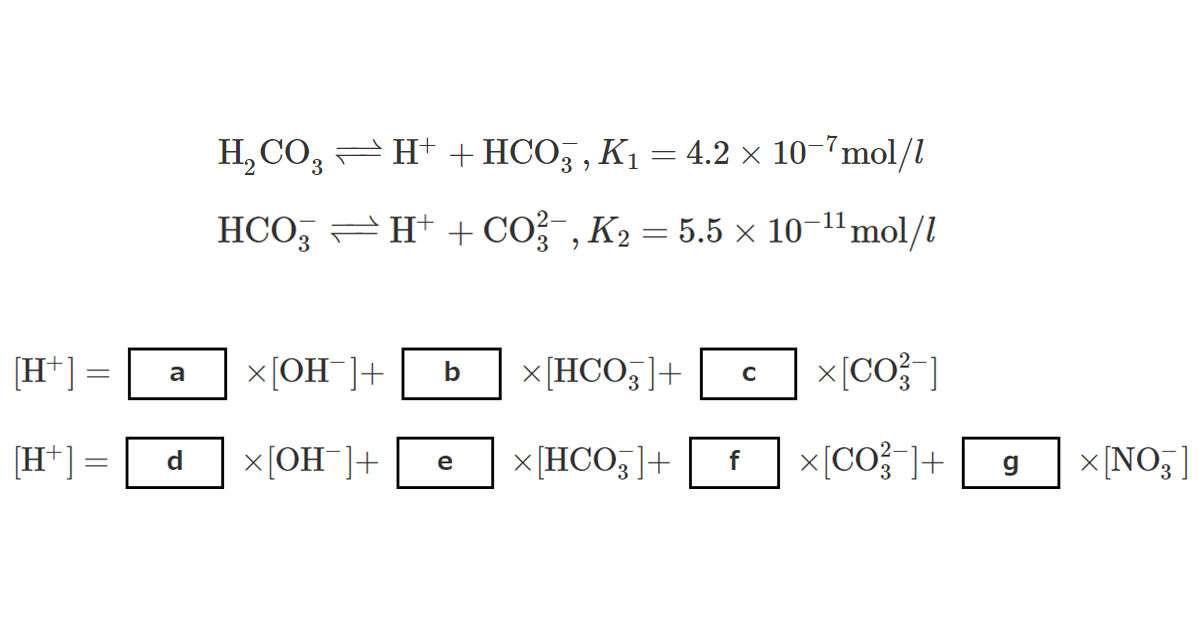
\( \ce{H2CO3 <=> H+ + HCO3-}, K_1 = 4.2 \times 10^{-7} \ce{mol} / l \) …(1)
さらに\( \ce{HCO3-} \)イオンの一部は, 以下の式に従って\( \ce{H+} \)イオンと\( \ce{CO3^2-} \)イオンとに電離する。
\( \ce{HCO3- <=> H+ + CO3^2-}, K_2 = 5.5 \times 10^{-11} \ce{mol} / l \) …(2)
このように\( \ce{H2CO3} \)は2段階で電離し, それぞれの電離定数は\( K_1, K_2 \)である。平衡状態での\( \ce{H2CO3} \)濃度を\( [\ce{H2CO3}] (\ce{mol} / l) \), \( \ce{H+} \)イオン濃度を\( [\ce{H+}] (\ce{mol} / l) \), \( \ce{HCO3-} \)イオン濃度を\( [\ce{HCO3-}] (\ce{mol} / l) \), \( \ce{CO3^2-} \)イオン濃度を\( [\ce{CO3^2-}] (\ce{mol} / l) \)とすると, (1)式で表される平衡反応より, \( [\ce{HCO3-}] \)は, \( [\ce{H2CO3}] \), \( [\ce{H+}] \), \( K_1 \)を用いて以下の式で表すことができる。
\( [\ce{HCO3-}] = \) Ⅰ …(3)
一方, (2)式の平衡反応より, \( [\ce{CO3^2-}] \)は, \( [\ce{HCO3-}] \), \( [\ce{H+}] \), \( K_2 \)を用いて以下のように表すことができる。
\( [\ce{CO3^2-}] = \) Ⅱ …(4)
(1)式および(2)式で与えられる電離ならびに水の電離により, 陽イオンとして\( [\ce{H+}] \), 陰イオンとして\( [\ce{OH-}] \), \( [\ce{HCO3-}] \), \( [\ce{CO3^2-}] \)が生成する。その溶液が全体として電気的に中性であることを考えると, 以下の式が成立する。
\( [\ce{H+}] = \) a \( \times [\ce{OH-}] + \) b \( \times [\ce{HCO3-}] + \) c \( \times [\ce{CO3^2-}] \) …(5)
二酸化炭素が溶け込んだ雨滴は, (1)式, (2)式により酸性となる。したがって, (5)式で\( [\ce{OH-}] \)は\( [\ce{H+}] \)に比べて小さく, 無視できる。一方\( [\ce{HCO3-}] \)と\( [\ce{CO3^2-}] \)とを比較すると, 雨滴が酸性の場合には(4)式より{Ⅲ:①\( [\ce{HCO3-}] \), ②\( [\ce{CO3^2-}] \)}の方が小さく, これも無視できる。これらより近似的に, 平衡状態での\( [\ce{H+}] \)を\( [\ce{H2CO3}] \)と電離定数とで表すことができる。この式から\( [\ce{H2CO3}] = \)ア\( \ce{mol} / l \)の時の\( [\ce{H+}] \)を求めると, \( [\ce{H+}] = \)イ\( \ce{mol} / l \)となり, \( \ce{pH} \)はウと計算される。
(B) このような過程で酸性となった雨滴に, 窒素酸化物や硫黄酸化物が溶け込むと, さらに\( \ce{pH} \)は低下する。これが酸性雨である。窒素酸化物の場合は, 最終的に雨滴中に硝酸が生じ, \( \ce{pH} \)が低下する。大気中の二酸化炭素と平衡状態に達した雨滴に, 硝酸が溶け込んだ場合を考える。このとき, 雨滴中には\( \ce{H+} \), \( \ce{OH-} \), \( \ce{HCO3-} \), \( \ce{CO3^2-} \), \( \ce{NO3-} \)の各イオンが存在し, 以下の式が成立する。
\( [\ce{H+}] = \) d \( \times [\ce{OH-}] + \) e \( \times [\ce{HCO3-}] + \) f \( \times [\ce{CO3^2-}] + \) g \( \times [\ce{NO3-}] \) …(6)
大気中の二酸化炭素と平衡条件下での\( [\ce{HCO3-}] \)および\( [\ce{CO3^2-}] \)は, (3)式, (4)式などを用いて計算できる。したがって, \( [\ce{H2CO3}] = \)ア\( \ce{mol} / l \)の条件で平衡となる雨滴は, \( \ce{NO3-} \)をエ\( \ce{mol} / l \)含むと\( \ce{pH} \)が\( 5.0 \)に, オ\( \ce{mol} / l \)含むと\( \ce{pH} \)が\( 4.0 \)に低下する。これが酸性雨の生成の一過程である。
問1 文中のア~オに適切な数値を記入せよ。なお, 数値は有効数字2けたで答えよ。
問2 文中のⅠ, Ⅱに適切な式を記入せよ。
問3 文中の{Ⅲ}のうち, 適切な方を番号で示せ。
問4 (5)式および(6)式中のa~gに適切な数値を記入せよ。
問5 窒素酸化物である一酸化窒素は, 大気中での反応により, 雨滴中に硝酸を生じさせる。その主要な過程を2段階の化学反応式で示せ。
解説
念のため, 化学でよく使う近似を確認しておく。\( a \pm b \)という式があるとき, \( a \gg b \)であれば, \( a \pm b \fallingdotseq a \)と近似できる。ここで, (掛け算ではなく)足し算ということが重要で, \( a \gg b \)はだいたい100倍程度と考えておけばよい。
つまり, 化学では, \( 100 + 1 \)は\( 100 \)と考えるのである。
(A)
ア
読解力の問題。問題文をよく読んで答えればよい。少し読み取りに時間がかかるかもしれないので, 所要時間3~5分くらいまでなら許容範囲。
Ⅰ, Ⅱ
簡単なので省略。
a~c
電離平衡の問題で頻出の, 電気的つりあいの式である。水溶液全体としては中性なので, プラスの電荷とマイナスの電荷が同じだけ存在する。
例えば, 体積\( V \)中の\( \ce{A+} \)と\( \rm{B}^{\color{red}{2}-} \)がつりあっているとき, プラスの電荷は\( [\ce{A+}] \times V [\ce{mol}] \), マイナスの電荷は\( [\ce{B^2-}] \times V \times \color{red}{2} [\ce{mol}] \)存在する。よって, \( [\ce{A+}] = \color{red}{2} [\ce{B^2-}] \)が成り立つ。
Ⅲ
常識的に考えて, 第1電離より第2電離の方が圧倒的に少ないので, \( [\ce{HCO3-}] \gg [\ce{CO3^2-}] \)と即座に判断してよい。
イ, ウ
ここまでの2つの近似(\( [\ce{OH-}] \)と\( [\ce{CO3^2-}] \)を無視)を使うと, 4変数だった式(5)が, 以下のように2変数となる。
\( [\ce{H+}] = [\ce{HCO3-}] \) …(5)’
与えられた情報は\( [\ce{H2CO3}] \)であるが, \( [\ce{H2CO3}] \)は平衡定数を介して\( [\ce{HCO3-}] \)と結びついているので, (5)’式より\( [\ce{H+}] \)が求まる。
(B)
d~f
a~cと同様で, 係数を見て瞬時に求められる。
エ, オ
(A)と同様の流れで, \( [\ce{OH-}] \)と\( [\ce{CO3^2-}] \)は無視できる。よって, 5変数だった式(6)が, 以下のように3変数となる。
\( [\ce{H+}] = [\ce{HCO3-}] + [\ce{NO3-}] \) …(6)’
今回も先ほどとまったく同様に, \( [\ce{HCO3-}] \)を電離定数を介して\( [\ce{H2CO3}] \)に変換してやると, \( [\ce{H+}] \), \( [\ce{H2CO3}] \), \( [\ce{NO3-}] \)だけの式になり, \( [\ce{NO3-}] \)以外の2つが与えられているので\( [\ce{NO3-}] \)が求まる。
問5
まず, 一酸化窒素は, 容易に酸化されて二酸化窒素になるのは常識(窒素を炭素に変えても同様)。
\( \ce{2NO + O2 -> 2NO2} \cdots ② \)
次に, 二酸化窒素から硝酸の反応は, オストワルト法(アンモニアから硝酸を作る方法)を思い出してほしい。そもそも②は, オストワルト法の3つの式の1つである。
$$\left\{
\begin{array}{l}
\ce{4NH3 + 5O2 -> 4NO + 6H2O \cdots} ① \\
\ce{2NO + O2 -> 2NO2 \cdots} ② \\
\ce{3NO2 + H2O -> 2HNO3 + NO \cdots} ③
\end{array}
\right.$$
よって, ③を書けばよい。
①③式は, 自力で導くのは難しいので, 出来れば暗記しておく。最低限, オストワルト法の3つの反応式のうち2つは, 右辺に\( \ce{NO} \)が来る, と覚えておくとよいだろう。
振り返り
電気的つり合いの式と近似を使って解く非常に典型的な問題。(A)→(B)と自然な一般化となっているので, 誘導にも乗りやすかったと思われる。
京大ではこの種の問題は最頻出であるので, 基本の流れを必ず押さえておく。
メインの平衡計算は易しい部類だが, こういう問題では意外と問5の反応式で差が付きやすい。教科書に載っている覚えにくい反応式は, 自信をもって書けるようにしておくこと。
コメント